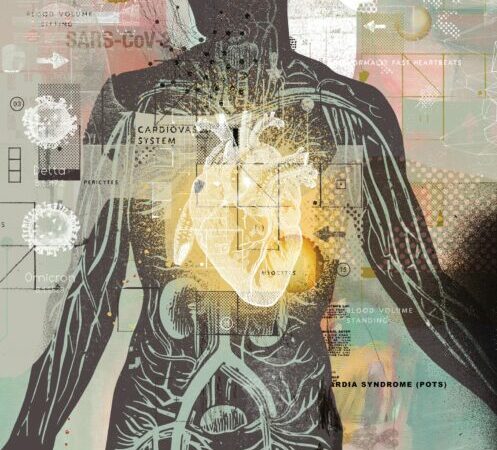
Durante l’ascesa della pandemia di COVID-19 all’inizio del 2020, i medici di Wuhan, in Cina, hanno iniziato a riferire che molti pazienti ricoverati con la malattia presentavano lesioni cardiache. Gli attacchi di cuore erano frequenti, soprattutto nei pazienti con fattori di rischio sottostanti e c’erano numerosi casi di miocardite, la quale si verifica quando gli strati muscolari del cuore diventano infiammati. Circa un quarto dei pazienti con grave COVID-19 aveva livelli elevati di troponina nel sangue, un segno di danni cardiaci.
Questa evidenza ha cambiato il modo in cui il COVID-19 veniva considerato; precedentemente soprattutto una forma di polmonite, ora assumeva anche una dimensione coronarica. “Abbiamo iniziato a capire che è anche una malattia cardiovascolare,” commenta Peter Libby, professore di medicina presso l’HMS e cardiologo presso il Brigham and Women’s Hospital.
Da allora le ospedalizzazioni e i decessi da COVID-19 sono diminuiti, come risultato delle vaccinazioni diffuse e dell’immunità crescente della popolazione contro la malattia grave. Ma il virus SARS-CoV-2, responsabile del COVID-19, è ancora con noi, insieme al rischio che pone alla salute del cuore, specialmente nelle persone con arterie ostruite, ipertensione, diabete e altri fattori predisponenti. Milioni di persone che si sono riprese dal COVID-19 hanno sviluppato sintomi cardiovascolari persistenti, tra cui battiti cardiaci irregolari, vertigini e mancanza di respiro.
Il numero di casi di COVID-19 sta di nuovo aumentando e il coronavirus continua a evolversi. La più recente variante omicron, BA.2.86, ha più di trenta mutazioni che potrebbero consentire di evitare le difese del sistema immunitario. Alla luce di questa minaccia in corso, la ricerca sugli effetti cardiovascolari del COVID-19 “rimane estremamente importante”, commente Anne-Marie Anagnostopoulos, una cardiologa ed insegnante di medicina presso l’HMS al Beth Israel Deaconess Medical Center. “Abbiamo bisogno di una maggiore comprensione della fisiopatologia associata per sviluppare trattamenti migliori.”
I problemi cardiaci a seguito del COVID-19
Nella maggior parte delle persone, soprattutto in coloro che sono stati vaccinati, il COVID-19 causa sintomi simili all’influenza che di solito si risolvono entro pochi giorni o settimane. Tuttavia, altre persone progrediscono verso una seconda e più pericolosa fase della malattia, in cui proteine pro-infiammatorie chiamate citochine proliferano nel sangue. Durante questa cosiddetta tempesta citochinica, il sistema immunitario diventa iperattivo, “causando una serie diversa di problemi”, commenta Dara Lee Lewis, MD ’92, insegnante di medicina presso l’HMS al Brigham and Women’s e direttore dei test non invasivi e co-direttore del programma di cardiologia delle donne presso il Lown Cardiology Group di Boston. “I pazienti possono sviluppare muscoli cardiaci deboli, livelli bassi di ossigeno, coaguli di sangue, liquido nei polmoni – problemi che possono richiedere il ricovero in ospedale”.
Inoltre, fattori di rischio cardiaci preesistenti, come la malattia arteriosa coronarica e l’obesità, possono predisporre i pazienti all’infiammazione metabolica e aumentare la probabilità di esiti negativi. Le persone con cuori vulnerabili, spiega Lee Lewis, sono più suscettibili a complicazioni da COVID-19 rispetto ad altre persone che non presentano questi fattori di rischio. Nel peggiore dei casi, i pazienti potrebbero sperimentare un’infarto miocardico di tipo 1, causato da un coagulo di sangue che blocca il flusso nelle arterie.
Tuttavia, i pazienti con COVID-19 sono anche particolarmente inclini a un altro tipo di infarto, chiamato infarto miocardico di tipo 2. In questi casi, il problema non è un’ostruzione delle arterie, ma piuttosto uno squilibrio tra l’apporto di ossigeno e la richiesta di ossigeno. La febbre e l’infiammazione accelerano il battito cardiaco e aumentano le richieste metaboliche su molti organi, compreso il cuore. Se i polmoni infetti non sono in grado di scambiare efficacemente ossigeno e anidride carbonica, i cuori stressati potrebbero subire danni a causa del mancato apporto di ossigeno.
Lee Lewis sottolinea che all’inizio della pandemia, la miocardite è stata anche una preoccupazione principale, soprattutto per gli atleti studenteschi. “Questi ragazzi non dovevano solo tornare al lavoro e alla vita”, commenta. “Dovevano tornare a giocare in modo competitivo.” Alcuni studenti da lei curati che erano stati malati di COVID-19 si sono presentati con dolore al petto, battiti cardiaci accelerati, mancanza di respiro e segni di miocardite alla risonanza magnetica.
Sono state riportate ricerche effettuate in tutto il mondo che fino a un terzo dei pazienti guariti dal COVID-19 mostravano anche evidenze di miocardite asintomatica negli studi di imaging. Questo è stato preoccupante, poiché la miocardite post-virale è una causa nota di morte improvvisa negli atleti. “Ci preoccupava che molti dei nostri studenti atleti non sarebbero stati in grado di tornare a giocare in modo competitivo”, dice Lee Lewis. Fortunatamente, i casi asintomatici si sono rivelati privi di eventi e gli studenti colpiti si sono ripresi completamente. “La miocardite asintomatica non è stata un grosso problema come temevamo inizialmente”, aggiunge Lee Lewis. “Quindi abbiamo smesso di fare risonanze magnetiche a tutti coloro che varcavano la soglia”.
Una spinta per comprendere il SARS-CoV-2
Non era del tutto inaspettato che il COVID-19 potesse essere così strettamente associato alla salute del cuore. Gli scienziati sapevano già che altri tipi di infezioni, come l’influenza e la sepsi batterica, possono amplificare i fattori di rischio cardiaci. Non è raro che le persone anziane abbiano placche inattive nelle arterie coronarie. Le placche possono essere destabilizzate da una risposta infiammatoria localizzata a infezioni remote. Il COVID-19 ha messo in luce queste connessioni e ha portato a una maggiore consapevolezza dell’interazione tra infezioni e malattie cardiache.
Come virus sconosciuto, il SARS-CoV-2 ha sollevato molte nuove domande. La ricerca ha dimostrato che i miociti, le cellule cardiache, sfuggono per la maggior parte all’infezione. Invece, il SARS-CoV-2 danneggia il cuore in modo indiretto scatenando reazioni infiammatorie che influenzano il funzionamento cardiovascolare. Una volta invaso il corpo, il SARS-CoV-2 si attacca a cellule ricoperte di recettori che sono suscettibili alla proteina spike del coronavirus. La proteina spike è fondamentale per l’infettività del virus. Una volta che la proteina spike si attacca ai recettori cellulari, agisce per consentire al SARS-CoV-2 di entrare in una cellula.
Le cellule epiteliali respiratorie sono considerate bersagli chiave dell’infezione, così come i periciti, che sono cellule che avvolgono i capillari. Una volta infettate dal virus, queste cellule rilasciano citochine che a loro volta agiscono su altri tipi di cellule che insieme formano il rivestimento interno di tutti i vasi sanguigni del corpo. Questo rivestimento, noto come l’endotelio vascolare, “può essere considerato un organo a sé stante”, dice Lee Lewis. “L’endotelio ha un ruolo fondamentale nel prevenire coaguli sanguigni inappropriati e nel consentire ai vasi sanguigni di contraarsi e dilatarsi”.
Di norma l’endotelio permette al sangue di fluire in uno stato liquido. Ma quando le citochine attivano le cellule endoteliali, queste assumono una postura difensiva: mobilitano i macrofagi e altre cellule immunitarie e rilasciano molecole che promuovono la coagulazione del sangue.
“Le citochine parlano a cellule in tutto il corpo”, spiega Jeremy Luban, professore presso la UMass Chan Medical School e membro del comitato esecutivo del Massachusetts Consortium on Pathogen Readiness, un’importante iniziativa multi-istituzionale promossa dalla HMS per rallentare la diffusione del COVID-19 e prepararsi per future pandemie. “Tra le cellule che potrebbero ascoltare ci sono le cellule endoteliali, che devono costantemente monitorare lo stato di coagulazione e danni ai tessuti e indurre azioni come la coagulazione per fermare il sanguinamento e altre misure per evitare danni ai tessuti”.
Tuttavia, i coaguli di sangue possono essere letali. Possono, ad esempio, ostruire le arterie che alimentano il cervello. Nei primi mesi della pandemia, le occlusioni arteriose sono state trovate in numerosi pazienti affetti da ictus, persino in giovani senza fattori di rischio predisponenti. Le autopsie dei pazienti deceduti per COVID-19 hanno rivelato coaguli in tutto il corpo e prove di insufficienza di organi multipli. Fino a un terzo dei pazienti ricoverati con COVID-19 hanno mostrato lesioni miocardiche attribuibili a coaguli microvascolari e disfunzione endoteliale, tra le altre condizioni.
Sindrome di tachicardia ortostatica posturale e infezione virale
Anche il danneggiamento microvascolare è stato implicato nei sintomi a lungo termine che costituiscono oggi un’attenzione crescente nella ricerca sul COVID-19. “Anche dopo cinque mesi dalla fase acuta della malattia, possiamo rilevare queste disfunzioni”, afferma Libby. Aggiunge che le risposte al mistero di ciò che causa il COVID-19 a lungo termine potrebbero essere trovate nella disfunzione microvascolare.
Bruce Levy, professore presso la HMS e co-fondatore del Brigham and Women’s COVID Recovery Center, è d’accordo. Il fatto che i microvasi siano presenti in tutto il corpo, commenta Levy, potrebbe spiegare perché il COVID-19 a lungo termine sia stato associato a più di 200 sintomi che colpiscono quasi tutti gli organi. La nebbia cerebrale e la confusione e “dimenticanza” che la accompagnano, ad esempio, potrebbero derivare dagli effetti dell’infiammazione sui vasi sanguigni del sistema nervoso centrale, mentre i sintomi cardiovascolari a lungo termine potrebbero derivare dall’infiammazione nei piccoli vasi che portano al cuore e lo circondano.
Un articolo che è apparso nell’agosto 2023 su Nature Medicine ha riportato un’ampia analisi dei dati sanitari raccolti dal Dipartimento degli Affari dei Veterani degli Stati Uniti durante un follow-up di due anni dei veterani che hanno sopravvissuto ai primi trenta giorni di infezione da SARS-CoV-2 e dati da un gruppo di controllo che non aveva mostrato evidenza di infezione. Lo studio ha esaminato il rischio di morte, ospedalizzazione e sequele polmonari e non polmonari. I risultati hanno mostrato che i problemi cardiaci a volte persistono anche nelle persone che non sono mai state ricoverate per COVID-19. Tuttavia, secondo Levy, la malattia iniziale grave è ancora il miglior predittore dei sintomi a lungo termine.
La sindrome posturale ortostatica da tachicardia (POTS) è qualcosa di cui dobbiamo essere vigili. Molti pazienti soffrono di essa per settimane o mesi prima di ricevere una diagnosi.
Tra i problemi più comuni persistenti – che interessano fino a un terzo di tutti i pazienti con long COVID – c’è la sindrome posturale ortostatica da tachicardia (POTS), che provoca un battito cardiaco anormalmente rapido. La POTS può essere diagnosticata se il test della frequenza cardiaca in posizione eretta misura un aumento sostenuto di almeno 30 battiti al minuto che persiste per dieci minuti o più dopo che il paziente si alza. In molti pazienti con POTS, la frequenza cardiaca in posizione eretta supera i 120 battiti al minuto. Le persone affette da questa condizione spesso si sentono stordite, faticano facilmente, hanno difficoltà a fare esercizio e sono inclini a svenire.
“La POTS è qualcosa su cui noi cardiologi, amici e vicini dobbiamo essere vigili”, commenta Lee Lewis. “Molte persone soffrono di questa condizione per settimane o mesi prima di ricevere una diagnosi”. La POTS interessa fino a tre milioni di persone negli Stati Uniti, la maggior parte delle quali donne tra i 15 e i 50 anni, inoltre, spesso inizia dopo la gravidanza, traumi o una grande operazione. Anche una storia familiare di POTS aumenta il rischio. Tuttavia, secondo Lee Lewis, i casi di POTS associati al COVID-19 possono interessare sia uomini che donne. Al momento, i clinici non sono certi sulla prognosi di questi pazienti.
Come si sviluppa la POTS innescata viralmente? Le prove sempre più numerose indicano gli effetti infiammatori sui nervi che controllano il flusso sanguigno e la frequenza cardiaca. Oltre ad agire direttamente sull’endotelio, l’infiammazione prende di mira piccole fibre nervose che stabiliscono quando i vasi sanguigni dovrebbero dilatarsi o restringersi. Gli impulsi inviati attraverso il sistema nervoso simpatico, ad esempio, normalmente direbbero ai vasi sanguigni di restringersi e alla frequenza cardiaca di aumentare durante la stazione eretta al fine di mantenere una pressione sanguigna adeguata al cervello. Tuttavia, nelle persone con POTS, i vasi sanguigni potrebbero non restringersi in modo appropriato. Al contrario, la frequenza cardiaca deve aumentare ancora di più del normale per compensare i vasi sanguigni “pigri”, dice Lee Lewis. Al contrario, il sistema nervoso parasimpatico entra in gioco quando il corpo si riposa, istruendo i vasi sanguigni alla dilatazione e istruendo il cuore a battere più lentamente in modo che la pressione sanguigna scenda.
Quando le persone stanno in piedi, il sangue si sposta alle estremità inferiori. Per contro a questo calo, il cervello attiva il rilascio di una raffica di noradrenalina, la quale segnala al sistema nervoso simpatico di far contrarre i vasi sanguigni e far battere il cuore più velocemente, spostando il sangue di nuovo al cervello e al torace. In qualcuno con POTS, quella risposta normale “viene scombussolata”, commenta Lee Lewis. I vasi non si restringono e il sangue rimane accumulato nelle gambe, ma la frequenza cardiaca deve aumentare ancora di più del normale per compensare i vasi sanguigni “pigri”.
I vasi sanguigni non si restringono e il sangue rimane accumulato nelle gambe, ma la frequenza cardiaca si accelera e rimane elevata.
Lee Lewis lavora spesso con Peter Novak, professore associato di neurologia presso il Brigham and Women’s e specialista in long COVID. Descrive POTS come una delle tante disautonomie risultanti da squilibri nel sistema nervoso autonomo che comprende i sistemi simpatico e parasimpatico. Il sistema nervoso autonomo controlla processi fisiologici involontari, non solo la frequenza cardiaca e la pressione sanguigna, ma anche la respirazione, la digestione e l’arousal sessuale. Novak stima che dal 60 all’80 percento dei pazienti con long COVID presentino sintomi di disfunzione autonomica, con POTS come il più comune.
Trattamenti per il long COVID
Levy descrive il long COVID come una pandemia post-pandemica. “Qualcosa come sessantacinque milioni di persone in tutto il mondo ne sono state colpite”, afferma, aggiungendo che il long COVID influisce profondamente sulla capacità delle persone di lavorare, andare a scuola o entrambi. Il COVID Recovery Center presso il Brigham and Women’s attualmente vede fino a 150 pazienti ogni mese e ha una lista d’attesa di quattro-sei settimane. Circa il 10 percento dei circa quattromila pazienti visitati finora è stato valutato per problemi cardiovascolari.
Secondo Anagnostopoulos, le strategie terapeutiche per i pazienti affetti da long COVID e sindrome simile a POTS o intolleranza all’esercizio e tachicardia enfatizzano l’esercizio leggero e l’allenamento strutturato alla resistenza. L’obiettivo è evitare una “spirale di discondizionamento” che potrebbe aggravare il problema originale. Simile a POTS, se i pazienti rimangono sedentari per troppo tempo, potrebbero sviluppare atrofia cardiaca e riduzione del volume di eiezione, il che significa che il cuore non pompa abbastanza sangue fuori dal ventricolo sinistro durante la contrazione, oppure potrebbero sviluppare tachicardia compensativa, caratterizzata da frequenze cardiache a riposo superiori a 100 battiti al minuto.
È importante riconoscere che questi pazienti stanno soffrendo”, commenta Anagnostopoulos. “Molti di loro sono giovani e non abituati a essere malati o trattenuti in qualsiasi modo da ciò che vogliono fare. Spesso sentono di non essere presi sul serio. Ciò che vogliono sapere è che il medico seduto davanti a loro sta sviluppando un piano per migliorare la situazione”. Anagnostopoulos fa riferimento a un rapporto del 2022 sul lungo COVID negli adulti dell’American College of Cardiology, che mette in guardia contro l’avvio del trattamento per la tachicardia o il POTS con esercizi in posizione eretta come il power walking o la corsa. Secondo il rapporto, queste attività potrebbero “aggravare la fatica, causando malessere post-sforzo”. Gli autori del rapporto raccomandano invece una strategia preliminare di esercizi in posizione supina e semi-supina, come il ciclismo stazionario e il canottaggio, con un’intensità crescente man mano che il paziente recupera la capacità funzionale.
I ricercatori stanno anche facendo progressi su come affrontare al meglio le minacce cardiovascolari nei pazienti acutamente malati di COVID-19. Data l’alta prevalenza di disturbi della coagulazione, potrebbe essere presumibile che gli anticoagulanti e i trattamenti antiaggreganti migliorino i risultati. Ma alcuni medici mettono in guardia contro il fatto che i rischi di sanguinamento di tali farmaci potrebbero superare i loro potenziali benefici. Stanno inoltre proseguendo gli studi sull’uso di anticitochine, come i glucocorticoidi e gli anticorpi monoclonali, per contrastare l’infiammazione sistemica.
Libby sottolinea che i futuri studi che indagano sugli effetti cardiovascolari del COVID-19 devono essere meglio coordinati. Una frenesia iniziale nel rispondere alla pandemia ha prodotto un diluvio di studi osservazionali e non randomizzati in questo ambito, afferma, i quali hanno generato più confusione che illuminazione.
Anche se la pandemia sembra attenuarsi, Luban raccomanda di non abbassare la guardia. La malattia cardiovascolare resta una delle principali cause di morte e, dopo anni di declino, i decessi per infarto e ictus sono aumentati di nuovo con la diffusione del virus SARS-CoV-2 in tutto il mondo. Fortunatamente, il virus non si è ancora evoluto in una forma più virulenta, dice, aggiungendo che “è incoraggiante constatare che la protezione dai vaccini contro l’ospedalizzazione e la malattia grave sembra resistere. Ma chi sa cosa succederà? Questo virus ci ha sorpreso ad ogni passo”.
C. Schmidt. Harvard Medicine the Magazine of Harvard Medical School.
COVID’s Damage Lingers in the Heart
October 2023.
Dr. Giovanni Ghirga